Книга 4. Розвиток атомної енергетики та об’єднаних енергосистем
ЧАСТИНА 2. Об’єднані енергосистеми та енергоутворення
Із самого початку було зрозуміло, що полоній, актиній і радій генеруються у мінералах, в яких вони містяться. Дослідженням цього питання вчені й зайнялись у першу чергу.
У вересні та листопаді 1903 року Е. Резерфорд і Ф. Содді писали про дослідження радіоактивного розпаду торію у журналі «Philosophical Magazin»: «Було наведено достатньо даних, щоб ясно показати, що в радіоактивності торію і радіоактивності радію відбиваються найскладніші перетворення, кожне з яких супроводжується безперервним утворенням особливого виду активної речовини».
Еманації, що утворюються із радію і торію, виявляються інертним газом, який, можливо, і є кінцевим продуктом розпаду. Пізніше вже в Англії у 1903 році В. Рамзай і Ф. Содді відкрили, що до складу продуктів розпаду радію входить гелій. А у 1908 році Е. Резерфорд і Г. Гейгер в Англії виміряли заряд ?-частинки і довели, що вона є двічі іонізованим атомом гелію.
У квітні та травні 1903 року в нових статтях Е. Резерфорда і Ф. Содді «Порівняльне вивчення радіоактивності радію і торію» та «Радіоактивне перетворення» з усією впевненістю стверджується, що «всі випадки радіоактивного перетворення, які вивчалися, зводяться до утворення однієї речовини з іншої (якщо враховувати випромінювані промені). Коли відбуваються декілька перетворень, то вони здійснюються не одночасно, а поступово». ...«Завдяки тому, що кожний наступний продукт розпаду в свою чергу перетворюється в новий елемент, вони можуть накопичуватись лише до того моменту, поки швидкість розпаду (пропорційна накопиченій кількості) врівноважить швидкість утворення (пропорційну кількості безпосередньо материнської речовини). Ця умова називається «умовою радіоактивної рівноваги». Внаслідок її виконання всі члени послідовного ряду радіоактивних елементів у мінералах існують в кількостях, пропорційних їх середньому часу життя; при цих умовах однакова кількість атомів усіх продуктів цього ряду (незалежно від загальної кількості речовини) розщеплюється одночасно і випромінює однакову кількість ?чи
?частинок за секунду. Е. Резерфорд і Ф. Содді сформулювали закон радіоактивного перетворення: «В усіх випадках, коли відокремлювали один із радіоактивних продуктів і досліджували його активність незалежно від радіоактивності речовини, з якої він утворився, було виявлено, що ця активність при усіх дослідженнях зменшується з часом за законом геометричної прогресії». Звідси випливає, що «швидкість перетворення весь час пропорційна кількості речовини, яка ще не зазнала перетворення»:
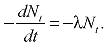
Відносна кількість радіоактивної речовини, що перетворюється за одиницю часу dNt Nt, є незмінна величина λ, яку Е. Резерфорд і Ф. Содді назвали радіоактивною сталою (тепер вона називається сталою радіоактивного розпаду). У тому ж році Е. Резерфорд і Ф. Содді об’єднали в перші ланцюги послідовного розпаду більше 10 радіоелементів.
У 1909 році шведські вчені Д. Стрьомгольм і Т. Сведберг при вивченні хімії радіоактивних елементів виявили, що багато з них невіддільні один від одного.
Після відкриття великої кількості природних радіоактивних елементів і формування правила зсуву місцеположення продукту розпаду в періодичній системі Д.І. Менделєєва щодо місцеположення в ній материнського елементу в залежності від природи випромінюваних ними променів стало зрозуміло, що багато радіоелементів претендують на одне і те ж місце.
У 1913 р. Ф. Содді вводить поняття ізотопії: атоми елемента даного порядкового номеру можуть відрізнятись масою ядра, швидкістю радіоактивного розпаду і природою випромінювання. У цьому ж році Д. Томсон виявляє, що елемент неон має атоми різної маси.
У січні 1913 року А. Ван ден Брук (в Голландії) висунув ідею, що порядковий номер елементу в періодичній системі дорівнює заряду ядра його атома. Цю ідею експериментально підтвердив у грудні 1913 року Г. Мозлі (в Англії) на прикладі низки елементів від кальцію до нікелю. Тим самим була розв’язана задача про дробову величину маси елемента: елемент містить атоми різної цілочислової маси у різних пропорціях.
Поняття ізотропії дозволило знайти місце в періодичній системі всім заново відкритим радіоактивним елементам. У подальшому всі ці елементи природного походження вдалося пов’язати у три сімейства: урану (238U), торію (232Th) і актиноурану (235U), показані на мал. 16.1.
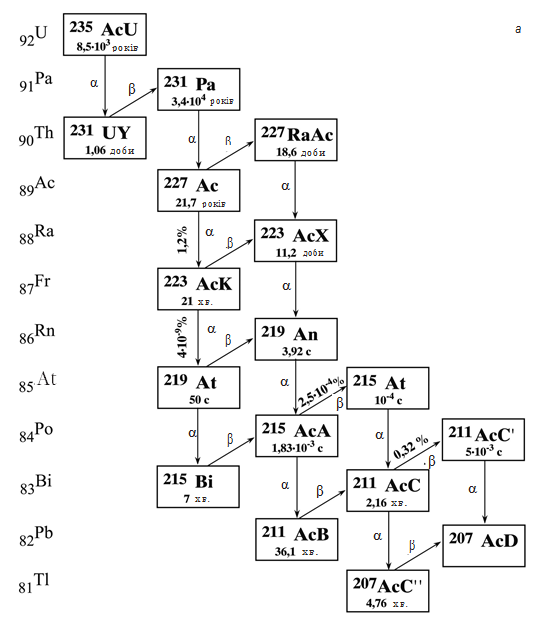
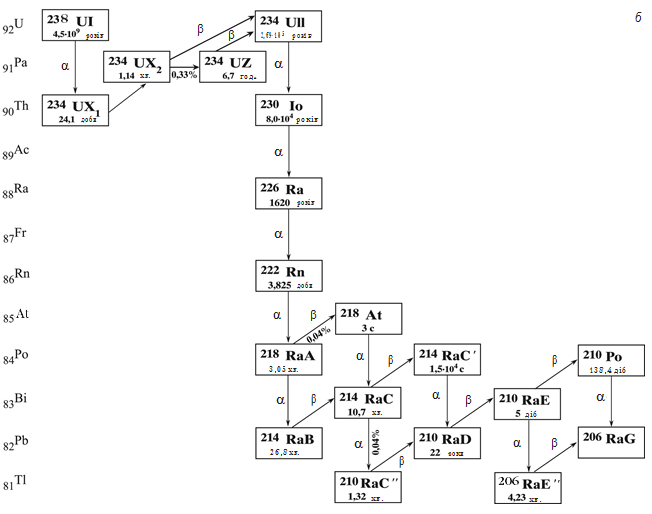
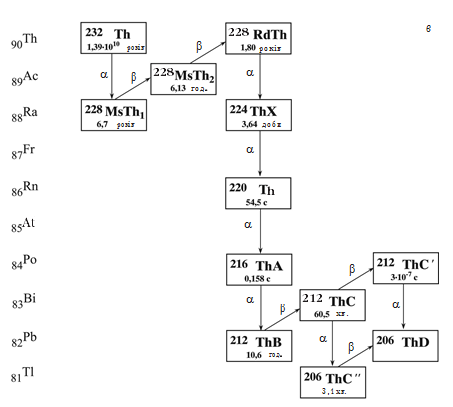 Мал. 16.1. Радіоактивні сімейства: а – актиноурану, б – урану, в – торію
Мал. 16.1. Радіоактивні сімейства: а – актиноурану, б – урану, в – торію
ЧАСТИНА 1. Атомна енергетика
Розділ 1. Процес об’єднання енергетичних систем: основні поняття й призначення



