Книга 2. Пізнання й досвід – шлях до сучасної енергетики
3.2.1. Будова атома
Все в світі складається з молекул, які являють собою складні комплекси взаємодіючих атомів. Молекули – це найменші частки речовини, які зберігають її хімічні властивості. Молекула складається з однакових (в простій речовині) або різних (в хімічній сполуці) атомів, об`єднаних хімічними зв`язками.
Атом – найменша частка хімічного елемента, яка є носієм його хімічних властивостей. Всі атоми хімічних елементів мають однакову структуру. Їх лінійний розмір в діаметрі становить приблизно 10-10м. Атом складається з позитивно зарядженого ядра і негативно заряджених електронів, які рухаються навколо ядра і розміщені на електронних орбітах атома.
Електрони в атомі згруповані на оболонках (шарах), які прийнято позначати літерами K, L, M, N, O, P, Q. Будова електронних оболонок підпорядкована строгому фізичному законові – «в одному атомі не може бути двох електронів, що знаходяться в одному і тому ж енергетичному стані». Цей стан визначається трьома параметрами: енергією зв`язку електрона в атомі, характером його обертання навколо ядра (орбітальним моментом) і обертання навколо власної осі (спіном). Кожна електронна орбіта відповідає цілком конкретному значенню енергії зв`язку, завдяки якому електрони утримуються в атомі. Електрони, що отримали додаткову енергію, можуть переходити на орбіту, більш віддалену від ядра, або взагалі залишати межі атома. Стан атома, в якому електрони перейшли з властивої їм оболонки на більш віддалену від ядра орбіту, є, як правило, нестійким. Час його перебування в такому збудженому стані не перевищує 10 -8 с. При переході електрона з віддаленої на ближчу до ядра орбіту виділяється енергія.
Ядро – центральна частина атома, що складається з позитивно заряджених протонів і нейтральних нейтронів. Ці частинки, які називаються нуклонами, утримуються в ядрах короткодіючими силами тяжіння, що виникають за рахунок обміну квантами так званої «сильної» взаємодії. Розміри ядра приблизно в 10–100 тисяч разів менше лінійних розмірів атома (діаметр ядра порядку 10 -14 м). Незважаючи на відносно малі розміри ядра, в ньому зосереджена практично вся маса атома, що обумовлює дуже високу щільність ядерної речовини. Маса ядра дещо нижче суми мас складаючих його протонів і нейтронів у вільному стані. Ця різниця називається «дефектом маси».
Ядро елемента X прийнято позначати як 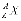 або X-A, де Z – заряд ядра, який дорівнює числу протонів, що визначає атомний номер ядра; A – масове число ядра, що дорівнює сумарному числу протонів і нейтронів.
або X-A, де Z – заряд ядра, який дорівнює числу протонів, що визначає атомний номер ядра; A – масове число ядра, що дорівнює сумарному числу протонів і нейтронів.
Протон – елементарна частинка, що має одиничний позитивний заряд, рівний за абсолютною величиною заряду електрона. Він є ядром атому найпростішого водню.
Нейтрон – незаряджена елементарна частинка з масою спокою, яка дещо перевищує масу протона. У вільному стані нейтрон – нестійка частинка і зазнає перетворень. Велика проникаюча здатність нейтронів пояснюється тим, що ці частинки не заряджені. Вони вільно пролітають крізь атоми, не взаємодіючи з їх електронами і не затримуючись у своєму русі, якщо тільки не стикаються з ядрами.
Протон і нейтрон позначаються відповідно 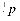 і
і 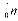 , де нижні індекси позначають заряд, а верхні – масу в атомних одиницях маси (а.о.м.), яка округляється до одиниці. В якості а.о.м. прийнята 1/12 частина маси атома вуглецю. Маса протона і нейтрона в 1840 разів більше маси електрона. Для протонів і нейтронів існує загальна назва нуклони. Позитивний заряд ядра визначається кількістю протонів у ньому.
, де нижні індекси позначають заряд, а верхні – масу в атомних одиницях маси (а.о.м.), яка округляється до одиниці. В якості а.о.м. прийнята 1/12 частина маси атома вуглецю. Маса протона і нейтрона в 1840 разів більше маси електрона. Для протонів і нейтронів існує загальна назва нуклони. Позитивний заряд ядра визначається кількістю протонів у ньому.
Атом будь-якого хімічного елемента характеризується двома головними параметрами: масовим числом і атомним номером елемента в Періодичній системі хімічних елементів Д.І. Менделєєва. Масове число А – сумарне число протонів і нейтронів в ядрі даного атома. Атомний номер Z – число протонів, що входять до складу ядра. Виходячи з цих визначень, число нейтронів в ядрі дорівнює N = A – Z.
Ядра елементів з однаковим числом протонів, але різним числом нейтронів називаються ізотопами. Як приклад можна навести природний уран, який має три ізотопи 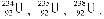 На сьогодні відомо близько 1500 ізотопів. Одні з них стійкі (стабільні), інші – нестійкі, радіоактивні.
На сьогодні відомо близько 1500 ізотопів. Одні з них стійкі (стабільні), інші – нестійкі, радіоактивні.
Заряд і масове число є основними характеристиками атомних ядер. Різновиди атомів, що визначаються певним масовим числом і атомним номером, називають нуклідами і позначають символом елемента із зазначенням атомного номера (внизу зліва) і масового числа (угорі ліворуч), наприклад: 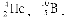 У періодичній системі елементи розташовані строго послідовно в порядку зростання заряду ядер їх атомів. При цьому властивості елементів перебувають у періодичній залежності від заряду ядер їх атомів. У кожному періоді системи хімічних елементів Д.І. Менделєєва йде побудова нового електронного шару, а у великих періодах також добудова внутрішніх шарів. Тому число електронних шарів в атомі зазвичай дорівнює номеру періоду, в якому знаходиться відповідний елемент.
У періодичній системі елементи розташовані строго послідовно в порядку зростання заряду ядер їх атомів. При цьому властивості елементів перебувають у періодичній залежності від заряду ядер їх атомів. У кожному періоді системи хімічних елементів Д.І. Менделєєва йде побудова нового електронного шару, а у великих періодах також добудова внутрішніх шарів. Тому число електронних шарів в атомі зазвичай дорівнює номеру періоду, в якому знаходиться відповідний елемент.
При нормальному стані атома кількість його електронів, що рухаються навколо ядра, відповідає кількості протонів в ядрі, що приводить до нейтралізації сумарних негативних зарядів електронів і позитивного заряду ядра. У цьому стані атом є електрично нейтральною системою.
Стійкість атомних ядер обумовлена ядерними силами тяжіння, які утримують нуклони в ядрі. Особливість їх полягає в тому, що вони досить великі на відстанях, співставних з розмірами ядра (в 2–3 рази перевершують сили відштовхування Кулона, що діють між зарядженими частками, які входять до складу ядра). Ця особливість ядерних сил обумовлена енергією зв`язку, яка становить кілька мільйонів електрон-вольт, що від кількох сотень до кількох тисяч разів перевищує енергію зв`язку електрона в атомі. При цьому важливо підкреслити, що стійкість ядер атомів забезпечується лише при цілком певних співвідношеннях протонів і нейтронів. Для легких ядер їх кількість майже однакова, для важких – кіькість нейтронів зростає. Ядра атомів, що знаходяться наприкінці таблиці Менделєєва (з атомним номером Z > 82), як правило, нестійкі. При збільшенні сумарного числа нуклонів зменшується сила ядерних тяжінь і ефект кулонівських сил відштовхування починає превалювати. У таких атомах сили ядерних тяжінь вже не вистачає для забезпечення повної стійкості ядер, що призводить до процесів їх внутрішньої перебудови (самовільним перетворенням), що супроводжуються виділенням енергії. Таким чином, у хімічних елементів з атомним номером (зарядом ядра) Z < 83 існують як стабільні, так і радіоактивні ізотопи. В елементів з атомним номером Z > 84 є лише радіоактивні ізотопи. Такі ізотопи називають радіонуклідами. Процес спонтанного переходу атомного ядра в інше ядро або ядра з випусканням при цьому різних частинок називається радіоак тивним розпадом, або радіоактивністю.
- Вступ
- ЧАСТИНА 1. Мистецтво пізнавати навколишній світ
- ЧАСТИНА 2. Розвиток вчення про теплоту, термодинаміку, теплопередачу і теплові машини
- Розділ 1. Теплота
- Розділ 2. Основи термодинаміки
- 2.1. Предмет і метод термодинаміки
- 2.2. Основні поняття і визначення
- 2.3. Перший закон термодинаміки
- 2.4. Другий закон термодинаміки
- 2.5. Поняття ексергії
- 2.6. Третій закон термодинаміки (тепловий закон Нернста)
- 2.7. Ентропія і невпорядкованість (статистичний характер другого закону термодинаміки)
- 2.8. Філософсько-методологічні основи другого закону термодинаміки
- 2.9. Термодинаміка на рубежі ХХІ століття. Стан і перспективи
- Розділ 3. Основи теплопередачі
- Розділ 4. Створення механізмів і машин для спалювання палива та використання теплової енергії
- ЧАСТИНА 3. Розвиток вчення про електрику і магнетизм. Становлення електроенергетики
- Розділ 5. Перші спостереження та експериментальні дослідження електрики і магнетизму. Відкриття основних властивостей і законів електрики
- 5.1. Перші відомості про електрику тертя і магнетизм
- 5.2. Електропровідність. Провідники та ізолятори
- 5.3. Два роди електричних зарядів. Закон Кулона
- 5.4. Електричне поле і його характеристики
- 5.5. Електрична ємність. Конденсатор
- 5.6. Електрична машина тертя. Індукційна машина
- 5.7. Досліди з електричним розрядом. Вивчення атмосферної електрики
- Розділ 6. Вивчення електричного струму. Встановлення основних законів електричного кола
- Розділ 7. Теплова і світлова дія електричного струму. Зародження основ електродинаміки
- Розділ 8. Винахід перших електричних машин. Створення центральних електричних станцій
- Розділ 9. Винахід електродвигунів та електричної тяги
- Розділ 10. Розвиток електротехнологій
- Розділ 11. Створення перших систем передачі й розподілу електричної енергії
- Розділ 12. Об'єднання електричних мереж для паралельної роботи. Створення енергетичних систем
- Розділ 13. Енергетика Росії на початку ХХ століття
- Розділ 14. План ГОЕЛРО – перший у світовій історії план розвитку народного господарства
- Розділ 15. Створення і становлення енергетичної системи України
- Розділ 5. Перші спостереження та експериментальні дослідження електрики і магнетизму. Відкриття основних властивостей і законів електрики
- ЧАСТИНА 4. Становлення атомної енергетики
- Висновок
- Коли б не вони... Хронологія найважливіших відкриттів у галузі енергетики
- Список використаної літератури
- Відомості про авторів



