Книга 2. Пізнання й досвід – шлях до сучасної енергетики
2.4. Другий закон термодинаміки
Перший закон термодинаміки, як уже було сказано, характеризує процеси перетворення енергії з кількісного боку. Другий закон термодинаміки характеризує якісний бік цих процесів. Перший закон термодинаміки дає все необхідне для складання енергетичного балансу якого-небудь процесу. Проте він не дає ніяких вказівок щодо можливості протікання того чи іншого процесу. Крім того, далеко не всі процеси реально здійснювані.
Варто підкреслити, що другий закон термодинаміки, так само як і перший, сформульований на основі досвіду.
Якщо виходити із першого закону термодинаміки, то можна допустити протікання будьякого процесу, який не суперечить закону збереження енергії. Зокрема, при теплообміні можна було б припустити, що теплота здатна передаватись як від тіл з більшою температурою до тіл з меншою температурою, так і навпаки. При цьому згідно з першим законом термодинаміки накладається лише одна умова: щоб кількість теплоти, що віддається одним тілом, дорівнювала кількості теплоти, яка приймається другим тілом.
Між тим із досвіду відомо, що теплота завжди самочинно передається лише від більш нагрітих тіл до менш нагрітих, тобто самочинний або природний процес теплообміну володіє властивістю направленості у бік тіл з більш низькою температурою, до того ж він припиняється при досягненні рівності температур тіл, що беруть участь у теплообміні.
Можливий і зворотний, не самочинний (штучний) процес передачі теплоти від менш нагрітих тіл до більш нагрітих (наприклад у холодильних установках), але для здійснення його вимагається підведення енергії ззовні.
Констатація цієї особливості теплоти, що проявляється в процесі її передачі, є однією із сторін сутності другого закону термодинаміки.
Прослідкуємо шлях, який привів фізиків до відкриття цього закону.
Найбільш важливі дослідження теплоти у першій половині ХІХ століття проводились з практичною метою покращити роботу парової машини. Англійський винахідник Джеймс Уатт (1736–1819) з найбільшою практичністю сформулював завдання: скільки вугілля вимагається для одержання певної роботи і якими засобами при заданій величині роботи можна звести до мінімуму кількість пального, що витрачається? За дослідження цієї практичної проблеми взявся молодий інженер Саді Карно.
«Проведав, что Природою дано
Стать силой движущей Огню,
Вошел в историю Карно,
Прославив молодость свою…»
(Э.Г. Братута)
Саді Карно був сином свого часу. Його теоретичні дослідження відповідали на конкретне питання, поставлене промисловістю, що розвивалась: як зробити тепловий двигун більш економічним. Результати своїх досліджень він підсумував у праці, що вийшла у 1824 р. «Роздуми про рушійну силу вогню і про машини, здатні розвивати цю силу» ( про цю працю вже згадувалось вище у 1.2). Поява цієї невеликої роботи стала початком нового етапу в історії фізики не лише завдяки одержаним в ній результатам, але і завдяки застосовуваному методу, який пізніше використовувався безліч разів. В основу свого розгляду Карно поклав неможливість здійснення вічного двигуна.
Своє дослідження Карно розпочинає із звеличення парових машин. Він констатує, що теорія теплових машин розвинута дуже погано, і відмічає, що для того, щоб вдосконалити її, потрібно дещо відірватись від чисто прикладного аспекту і розглянути рушійну силу вогню в загальному вигляді.
За допомогою уявного експерименту Карно довів, що якщо виходити з неможливості вічного двигуна, то для одержання роботи необхідно мати в машині два тіла з різними температурами, до того ж теплород має переходити від тіла з більш високою температурою до тіла з більш низькою. Уподібнюючи теплород воді, а різницю температур – різниці рівнів води, Карно робить висновок, що як при падінні води робота вимірюється добутком ваги води на різницю рівнів, так і в паровій машині робота незалежно від природи робочої речовини (вода, спирт і т.д.) вимірюється добутком кількості теплороду на різницю температур. У 1824 році Карно висловив геніальну думку: для одержання роботи в тепловій машині необхідна різниця температур, необхідні два джерела теплоти з різними температурами. Іншими словами, віддача теплової машини обмежена значеннями температур нагрівника і холодильника. Як підкреслює Карно, холодильник – такий же необхідний елемент, як і котел, до того ж, якщо у машині не передбачений спеціальний охолоджуючий елемент, то його роль відіграє навколишнє середовище. Все це і є суттю «принципу Карно», або другого закону термодинаміки, як він став називатись пізніше, після того як цьому розділу фізики було надано аксіоматичну побудову.
 Саді Карно (1796–1832) – французький фізик і військовий інженер – захоплювався вивченням і удосконаленням парових машин, а також вивчав теплоту як форму матерії. Карно був першим вченим, який розпочав кількісне вивчення взаємоперетворення теплоти і роботи, тому його з повним правом можна назвати батьком термодинаміки. Він ввів найважливіше для термодинаміки поняття оборотного процесу і заклав основи другого закону термодинаміки. Пізніше лорд Кельвін сказав щодо Карно, що «це був найбільш глибокий спеціаліст з термодинаміки у першій третині ХІХ століття». Карно був досить практичною людиною і вважав, що головна мета занять наукою – приносити користь людям.
Саді Карно (1796–1832) – французький фізик і військовий інженер – захоплювався вивченням і удосконаленням парових машин, а також вивчав теплоту як форму матерії. Карно був першим вченим, який розпочав кількісне вивчення взаємоперетворення теплоти і роботи, тому його з повним правом можна назвати батьком термодинаміки. Він ввів найважливіше для термодинаміки поняття оборотного процесу і заклав основи другого закону термодинаміки. Пізніше лорд Кельвін сказав щодо Карно, що «це був найбільш глибокий спеціаліст з термодинаміки у першій третині ХІХ століття». Карно був досить практичною людиною і вважав, що головна мета занять наукою – приносити користь людям.
Клаузіусу довелось захищати принцип Карно (другий закон термодинаміки) від численних атак. Він вивів його з іншого постулату, який уявляється інтуїтивно більш очевидним, ніж прийнятий Карно. Новий постулат Клаузіуса говорить, що теплота не може самочинно переходити від більш холодного тіла до більш гарячого без участі третього тіла. Слово «самочинно» тут стоїть, щоб вказати, що коли іноді такий перехід має місце, як, скажемо, в розчинах, в холодильних машинах і т.ін., то він певною мірою «вимушений», тобто супроводжується другим, компенсуючим, явищем. Цьому новому постулату Клаузіуса незабаром були надані інші еквівалентні формулювання: явища природи необоротні; явища відбуваються так, що енергія завжди вироджується, і т.ін.
У найбільш загальному вигляді другий закон термодинаміки може бути сформульований наступним чином: будь-який реальний самочинний процес є необоротним. Всі інші формулювання другого закону термодинаміки є частковими випадками цього найбільш загального формулювання.
У. Томсон (лорд Кельвін) запропонував у 1851 році наступне формулювання другого закону термодинаміки: неможливо за допомогою неживого матеріального агента одержати від якої-небудь маси речовини механічну роботу шляхом охолодження її нижче температури найхолоднішого із навколишніх предметів.
Макс Планк дав таке формулювання: неможливо побудувати періодично діючу машину, всі дії якої зводились би до піднімання деякого вантажу і охолодження теплового джерела. Під періодично діючою машиною слід розуміти двигун, що безперервно (у циклічному процесі) перетворює теплоту у роботу. Насправді, якби вдалось побудувати тепловий двигун, який просто забирав би теплоту від деякого джерела і безперервно (циклічно) перетворював її у роботу, то це б суперечило сформульованому раніше положенню про те, що робота може здійснюватись системою лише тоді, коли в цій системі відсутня рівновага (зокрема, відповідно до теплового двигуна, коли у системі є різниця температур гарячого і холодного джерел).
 Уїльям Томсон (1824–1907) (з 1892 року за наукові досягнення одержав титул лорда Кельвіна) – відомий англійський фізик – залишив після себе 25 книг, 660 наукових статей і 70 винаходів у сфері термодинаміки, теорії електричних і магнітних явищ. Він запропонував абсолютну шкалу температур (шкала Кельвіна), експериментально відкрив низку ефектів (у тому числі ефект Джоуля–Томсона), встановив залежність періоду коливань контуру від його ємності та індуктивності (формула Томсона), винайшов численні електровимірювальні прилади, розробив термодинамічну теорію термо-електричних явищ, був активним учасником здійснення телеграфного зв'язку по трансатлантичному кабелю. У віці 27 років став членом Лондонського королівського товариства.
Уїльям Томсон (1824–1907) (з 1892 року за наукові досягнення одержав титул лорда Кельвіна) – відомий англійський фізик – залишив після себе 25 книг, 660 наукових статей і 70 винаходів у сфері термодинаміки, теорії електричних і магнітних явищ. Він запропонував абсолютну шкалу температур (шкала Кельвіна), експериментально відкрив низку ефектів (у тому числі ефект Джоуля–Томсона), встановив залежність періоду коливань контуру від його ємності та індуктивності (формула Томсона), винайшов численні електровимірювальні прилади, розробив термодинамічну теорію термо-електричних явищ, був активним учасником здійснення телеграфного зв'язку по трансатлантичному кабелю. У віці 27 років став членом Лондонського королівського товариства.
Якби не існувало обмежень, що накладаються другим законом термодинаміки, то це значило б, що можна побудувати тепловий двигун за наявності лише одного джерела теплоти. Такий двигун міг би діяти за рахунок охолодження, наприклад, води в океані. Цей процес міг би продовжуватись до того часу, поки вся внутрішня енергія океану не була б перетворена у роботу. Теплову машину, яка діяла б таким чином, німецький фізикохімік В.Ф. Освальд (1853–1932) вдало назвав вічним двигуном другого роду (на відміну від вічного двигуна першого роду, що працював би всупереч закону збереження енергії). У відповідності зі сказаним формулювання другого закону термодинаміки, запропоноване Планком, може бути змінене наступним чином: здійснення вічного двигуна другого роду неможливе. Варто відмітити, що існування вічного двигуна другого роду не суперечить першому закону термодинаміки; по суті у цьому двигуні робота проводилась би не із нічого, а за рахунок внутрішньої енергії, зосередженої у тепловому джерелі.
Підкреслимо важливу особливість теплових процесів. Механічну роботу, електричну роботу, роботу магнітних сил і т.д. можна без залишку, повністю, перетворити у теплоту. Що ж стосується теплоти, то лише частина її може бути перетворена у механічну роботу та інші види роботи в процесі, що періодично повторюється; друга її частина неминуче має бути передана холодному джерелу. У цьому суть другого закону термодинаміки.
За одним із постулатів У. Томсона неможливе здійснення циклу теплового двигуна без перенесення деякої кількості теплоти від джерела тепла з більш високою температурою до джерела з більш низькою температурою. Із постулату Томсона випливає неможливість одержання роботи в тепловому двигуні, рівної віднятій від гарячого джерела теплоті Q1, тобто обов'язково має виконуватись нерівність L<Q1.
Але за законом збереження енергії
L=Q1– Q2,
де Q2 – теплота, відведена до холодного джерела.
Тому в теплових двигунах, якої б конструкції вони не були, завжди має бути Q2>0. Відношення роботи L до теплоти Q1 називають термічним коефіцієнтом корисної дії
ηt=(L/Q1)<1.
Таким чином, термічний к.к.д. теплового двигуна завжди має бути меншим одиниці. Це положення вперше було доведено С. Карно (1824 р.) шляхом розгляду можливої роботи ідеального (оборотного) теплового двигуна в умовах безкінечноємних гарячого і холодного джерел теплоти (T1=const і T2=const).
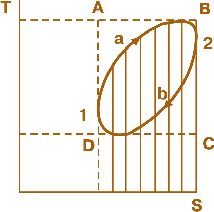 Мал. 2.1. TS діаграма термодинамічного кругового процесу
Мал. 2.1. TS діаграма термодинамічного кругового процесу
С. Карно довів, що максимальний термічний к.к.д. ідеального теплового двигуна в умовах сталості температур T1 и T2 складає величину:
ηt=1–(T2/T1)<1.
Аналізуючи висновки Карно, Клаузіус відмітив, що у випадку ідеального теплового двигуна зберігається співвідношення
Q1/T1 = Q2/T2.
Виходячи з цього, Клаузіусом наприкінці ХІХ століття була запроваджена нова термодинамічна функція – ентропія, що визначається як відношення кількості підведеної чи відведеної теплоти до абсолютної температури її підведення чи відведення:
Ѕ = Q/T.
Ця нова величина – ентропія (від грецького εν– в та τροπη – поворот, перетворення) – математично точно визначена, але фізично мало наочна. Клаузіус виявив, що абсолютне значення ентропії залишається невизначеним, визначені лише її зміни у термічно ізольованих необоротних системах; в ідеальному випадку оборотних процесів ентропія залишається постійною.
Введенню цієї нової величини дуже енергійно протидіяли фізики, особливо через її таємничий характер, обумовлений головним чином тим, що вона не діє на наші органи чуття. Оскільки її зміна дорівнює нулю для ідеальних оборотних процесів і позитивна для реальних, то ентропія є мірою відхилення реального процесу від ідеального. Цим пояснюється введена Клаузіусом назва цієї величини, яка етимологічно означає «зміну».
Введення цієї величини дозволило створити температурно-ентропійні, або так звані TS-діаграми (мал. 2.1), за допомогою яких оцінюють термодинамічні процеси і визначають ефективність теплових двигунів.
На площині такої діаграми кожна точка відповідає певному стану газоподібного робочого тіла, оскільки для кожної з них відомі дві величини – параметри стану, що характеризують газ. У даному випадку ними будуть T і S (тобто температура і ентропія).
Якщо до певної кількості газу, стан якого визначено на малюнку точкою 1, підвести певну кількість теплоти dQ, то система перейде шляхом а до стану, що характеризується точкою 2, а потім внаслідок відведення теплоти система шляхом b повернеться до початкового стану (точка 1). Це означає, що система здійснила круговий процес.
Для будь-якої елементарної ділянки такого процесу існує залежність
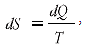
де dS – збільшення функції стану системи – ентропії, кДж/К; dQ – кількість підведеної теплоти, кДж; T – температура, за якої підводиться теплота, К.
Оскільки dQ=TdS, то зрозуміло, що кількість підведеної теплоти у будь-якому процесі, в тому числі й у процесі а, визначається на TSдіаграмі в певному масштабі площею, позначеною вертикальними штрихами, а кількість відведеної теплоти – площею з похилими штрихами. Площа, обмежена кривими 1 – 2 та 2 – 1, є різницею між визначеними площами. Вона характеризує кількість теплоти, що перетворюється, згідно із законом збереження енергії, в роботу, виконану 1 кг газу за цикл.
Термодинамічний к.к.д. циклу визначається як відношення цієї площі до заштрихованої вертикальними лініями, що відповідає підведеній енергії. Отже, із сказаного випливає, що к.к.д. зростає тим більше, чим вище розташована верхня крива та нижче – нижня.
Якщо верхня і нижня температурні границі циклу жорстко визначені (на мал. 2.1 вони позначені пунктиром), тоді к.к.д. тим вищий, чим ближчою до прямокутника ABCD буде форма площі циклу 1–2 і 2–1. Цикл, який на TS-діаграмі зображено таким прямокутником, дістав назву циклу Карно. К.к.д. циклу Карно неможливо перевищити жодними засобами, а його величина залежить лише від температури: найвищої (ізотерма АВ) та найнижчої (ізотерма DC):
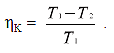
У цьому полягає суть другого закону термодинаміки. Із рівняння видно, що основним шляхом збільшення ефективності теплових двигунів є підвищення верхньої температури T1, за якої теплота підводиться до робочого тіла, і зниження нижньої температури T2, за якої теплота відводиться.
](/images/Kniga_2/Image_052.gif) Мал. 2.2. Процеси в газах
Мал. 2.2. Процеси в газах
(ізоентропи, ізотерми, ізохори, ізобари)
Теплота врешті-решт відводиться до навколишнього середовища (у повітря або у воду). У зв'язку з цим мінімально можлива температура відведення теплоти близька до температури цих середовищ.
Співвідношення, справедливе і для оборотних (знак рівності), й для необоротних (знак >) процесів у будь-якій системі, являє собою аналітичний вираз другого закону термодинаміки:
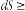
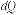
Щодо процесів, з яких складається цикл Карно (див. мал. 2.1), не було висунуто умов відносно їх перебігу, крім того, що у процесі а теплота підводиться, а в процесі b – відводиться. Насправді серед численних можливих процесів часто виділяються чотири види, умовою здійснення яких є сталість одного із параметрів стану газу (мал. 2.2).
1. Ізотермічний процес відбувається при сталій температурі; на TS-діаграмі зображується горизонтальними лініями.
2. Ізоентропний процес розширення або стиснення відбувається без тертя таким чином, що теплота до газу не підводиться і не відводиться (dQ=0). На TS-діаграмі цей процес зображується вертикальними прямими.
3. Ізобарний процес здійснюється за постійного тиску p. Такі процеси дуже поширені в природі й техніці. На TS-діаграмі ізобару зображено кривою лінією.
4. Ізохорні зміни стану газу відбуваються, коли його нагрівають або охолоджують при постійному об'ємі. Ізохора на TS-діаграмі зображена пунктирною кривою, але вона більш крута, ніж ізобара.
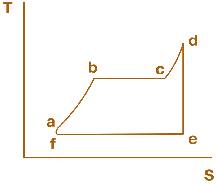 Мал. 2.3. Термодинамічний цикл, за яким працює традиційна установка теплової електричної станції (пароводяний цикл Ренкіна)
Мал. 2.3. Термодинамічний цикл, за яким працює традиційна установка теплової електричної станції (пароводяний цикл Ренкіна)
Термодинамічний цикл теплових двигунів зазвичай складається з ряду вищеназваних процесів. Для ілюстрації наведемо в TS-діаграмі термодинамічний цикл, за яким працює традиційна установка теплової електричної станції, так званий пароводяний цикл Ренкіна (мал. 2.3).
Живильна вода, що надходить до парового котла, нагрівається в ньому (ізобара а–b), випаровується (ізотерма, що збігається з ізобарою b–с), утворена пара перегрівається у пароперегрівачі (ізобара с–d) до температури Т1. Далі в турбіні відбувається ізоентропне розширення пари (ізоентропа d–е), а в конденсаторі при Т2=const – її конденсація (ізотерма е–f, яка збігається з ізобарою). Потім конденсат подається насосом до котла (ізоентропа f–а).
2.3. Перший закон термодинаміки
2.5. Поняття ексергії



