Книга 2. Познание и опыт - путь к современной энергетике
2.4. Второй закон термодинамики
Первый закон термодинамики, как уже сказано, характеризует процессы превращения энергии с количественной стороны. Второй закон термодинамики характеризует качественную сторону этих процессов. Первый закон термодинамики дает все необходимое для составления энергетического баланса какоголибо процесса. Однако он не дает никаких указаний относительно возможности протекания того или иного процесса. Между тем далеко не все процессы реально осуществимы.
Следует подчеркнуть, что второй закон термодинамики, так же как и первый закон, сформулирован на основе опыта.
Проследим путь, приведший физиков к открытию этого закона.
Наиболее важные исследования теплоты в первой половине XIX века проводились с практической целью улучшить работу паровой машины. Английский изобретатель Джеймс Уатт (1736–1819) с предельной практичностью сформулировал задачу: сколько угля требуется, чтобы получить определенную работу, и какими способами при заданной величине работы можно свести к минимуму количество расходуемого горючего?
За исследование этой практической проблемы взялся молодой инженер Сади Карно.
Если исходить из первого закона термодинамики, то можно допустить протекание любого процесса, который не противоречит закону сохранения энергии. В частности, при теплообмене можно было бы предположить, что теплота может передаваться как от тела с большей температурой к телу с меньшей температурой, так и наоборот. При этом согласно первому закону термодинамики накладывается только одно условие: чтобы количество теплоты, отданной одним телом, равнялось количеству теплоты, принятой другим телом.
Между тем из опыта известно, что теплота всегда самопроизвольно передается только от более нагретых тел к менее нагретым, т.е. самопроизвольный или естественный процесс теплообмена обладает свойством направленности в сторону тел с более низкой температурой, причем он прекращается при достижении равенства температур участвующих в теплообмене тел.
Возможен и обратный, не самопроизвольный (искусственный) процесс передачи теплоты от менее нагретых тел к более нагретым (например в холодильных установках), но для осуществления его требуется подвод энергии извне.
Констатация этой особенности теплоты, проявляющейся в процессе ее передачи, является одной из сторон сущности второго закона термодинамики.
«Проведав, что Природою дано
Стать силой движущей Огню,
Вошел в историю Карно,
Прославив молодость свою…»
(Э.Г. Братута)
Сади Карно был сыном своего века. Его теоретические исследования отвечали на конкретный вопрос, поставленный развивающейся промышленностью: как сделать тепловой двигатель более экономичным. Результаты своих исследований он подытожил в работе, вышедшей в 1824 г., «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (об этой работе уже упоминалось выше в 1.2). Появление этой небольшой работы стало началом нового этапа в истории физики не только благодаря полученным в ней результатам, но и благодаря примененному методу, который впоследствии использовался бесчисленное множество раз. В основу своего рассмотрения Карно положил невозможность осуществления вечного двигателя.
Свое исследование Карно начинает с восхваления паровых машин. Он констатирует, что теория этих машин развита очень слабо, и замечает, что для того, чтобы продвинуть ее, нужно несколько оторваться от чисто прикладного аспекта и рассмотреть движущую силу огня в общем виде.
 Сади Карно (1796–1832) – французский физик и военный инженер – занимался изучением и усовершенствованием паровых машин, а также изучал теплоту как форму энергии. Карно был первым ученым, начавшим количественное изучение взаимопревращения теплоты и работы, поэтому его с полным правом можно назвать отцом термодинамики. Он ввел важнейшее для термодинамики понятие обратимого процесса и заложил основы второго начала термодинамики. Позднее лорд Кельвин сказал о Карно, что «это был самый глубокий специалист по термодинамике в первой трети XIX века». Карно был очень практичным человеком и считал, что главная цель занятий наукой – приносить пользу людям.
Сади Карно (1796–1832) – французский физик и военный инженер – занимался изучением и усовершенствованием паровых машин, а также изучал теплоту как форму энергии. Карно был первым ученым, начавшим количественное изучение взаимопревращения теплоты и работы, поэтому его с полным правом можно назвать отцом термодинамики. Он ввел важнейшее для термодинамики понятие обратимого процесса и заложил основы второго начала термодинамики. Позднее лорд Кельвин сказал о Карно, что «это был самый глубокий специалист по термодинамике в первой трети XIX века». Карно был очень практичным человеком и считал, что главная цель занятий наукой – приносить пользу людям.
С помощью мысленного эксперимента Карно доказал, что если исходить из невозможности вечного двигателя, то для получения работы необходимо иметь в машине два тела с различными температурами, причем теплород должен переходить от тела с более высокой температурой к телу с более низкой. Уподобляя теплород воде, а разность температур – разности уровней воды, Карно заключает, что как при падении воды работа измеряется произведением веса воды на разность уровней, так и в паровой машине работа независимо от природы рабочего вещества (вода, спирт и т. д.) измеряется произведением количества теплорода на разность температур. В 1824 году Карно высказал гениальную мысль: для производства работы в тепловой машине необходима разность температур, необходимы два источника теплоты с различными температурами. Иными словами, отдача тепловой машины ограничена значениями температур нагревателя и холодильника. Как подчеркивает Карно, холодильник – столь же необходимый элемент, как и котел, причем если в машине не предусмотрен специальный охлаждающий элемент, то его роль играет окружающая среда. Все это и представляет собой суть «принципа Карно», или второго начала термодинамики, как он стал называться позже, после того как этому разделу физики было придано аксиоматическое построение.
Клаузиусу пришлось защищать принцип Карно (второе начало термодинамики) от многочисленных атак. Он вывел его из другого постулата, который представляется интуитивно более очевидным, чем принятый Карно. Новый постулат Клаузиуса гласит, что теплота не может самопроизвольно переходить от более холодного тела к более горячему без участия третьего тела. Слово «самопроизвольно» стоит здесь, чтобы указать, что если иногда такой переход имеет место, как, скажем, в растворах, в холодильных машинах и т. п., то он в известном смысле «вынужденный», т. е. сопровождается другим, компенсирующим, явлением. Этому новому постулату Клаузиуса вскоре были даны другие эквивалентные формулировки: явления природы необратимы; явления происходят так, что энергия всегда вырождается, и т. п.
В наиболее общем виде второй закон термодинамики может быть сформулирован следующим образом: любой реальный самопроизвольный процесс является необратимым. Все прочие формулировки второго закона являются частными случаями этой наиболее общей формулировки.
У. Томсон (лорд Кельвин) предложил в 1851 году следующую формулировку второго закона термодинамики: невозможно при помощи неодушевленного материального агента получить от какой-либо массы вещества механическую работу путем охлаждения ее ниже температуры самого холодного из окружающих предметов.
Mакс Планк дал такую формулировку: невозможно построить периодически действующую машину, все действие которой сводилось бы к поднятию некоторого груза и охлаждению теплового источника. Под периодически действующей машиной следует понимать двигатель, непрерывно (в циклическом процессе) превращающий тепло в работу. В самом деле, если бы удалось построить тепловой двигатель, который просто отбирал бы тепло от некоторого источника и непрерывно (циклично) превращал его в работу, то это противоречило бы сформулированному ранее положению о том, что работа может производиться системой только тогда, когда в этой системе отсутствует равновесие (в частности, применительно к тепловому двигателю, когда в системе имеется разность температур горячего и холодного источников).
 Уильям Томсон (1824–1907) (в 1892 году за научные заслуги получил титул лорда Кельвина) – известный английский физик оставил после себя 25 книг, 660 научных статей и 70 изобретений в сфере термодинамики, теории электрических и магнитных явлений. Он предложил абсолютную шкалу температур (шкала Кельвина), экспериментально открыл ряд эффектов (в том числе эффект Джоуля–Томсона), установил зависимость периода колебаний контура от его емкости и индуктивности (формула Томсона), изобрел многие электроизмерительные приборы, разработал термодинамическую теорию термоэлектрических явлений, был активным участником осуществления телеграфной связи по трансатлантическому кабелю. В возрасте 27 лет стал членом Лондонского королевского общества.
Уильям Томсон (1824–1907) (в 1892 году за научные заслуги получил титул лорда Кельвина) – известный английский физик оставил после себя 25 книг, 660 научных статей и 70 изобретений в сфере термодинамики, теории электрических и магнитных явлений. Он предложил абсолютную шкалу температур (шкала Кельвина), экспериментально открыл ряд эффектов (в том числе эффект Джоуля–Томсона), установил зависимость периода колебаний контура от его емкости и индуктивности (формула Томсона), изобрел многие электроизмерительные приборы, разработал термодинамическую теорию термоэлектрических явлений, был активным участником осуществления телеграфной связи по трансатлантическому кабелю. В возрасте 27 лет стал членом Лондонского королевского общества.
Если бы не существовало ограничений, накладываемых вторым законом термодинамики, то это означало бы, что можно построить тепловой двигатель при наличии одного лишь источника тепла. Такой двигатель мог бы действовать за счет охлаждения, например, воды в океане. Этот процесс мог бы продолжаться до тех пор, пока вся внутренняя энергия океана не была бы превращена в работу. Тепловую машину, которая действовала бы таким образом, немецкий физикохимик В. Ф. Оствальд (1853–1932) удачно назвал вечным двигателем второго рода (в отличие от вечного двигателя первого рода, работающего вопреки закону сохранения энергии). В соответствии со сказанным формулировка второго закона термодинамики, данная Планком, может быть видоизменена следующим образом: осуществление вечного двигателя второго рода невозможно. Следует заметить, что существование вечного двигателя второго рода не противоречит первому закону термодинамики; в самом деле, в этом двигателе работа производилась бы не из ничего, а за счет внутренней энергии, заключенной в тепловом источнике.
Подчеркнем важную особенность тепловых процессов. Механическую работу, электрическую работу, работу магнитных сил и т. д. можно без остатка, полностью, превратить в теплоту. Что же касается теплоты, то только часть ее может быть превращена в периодически повторяющемся процессе в механическую работу и иные виды работы; другая ее часть неизбежно должна быть передана холодному источнику. В этом суть второго закона термодинамики.
По одному из постулатов У. Томсона невозможно осуществление цикла теплового двигателя без переноса некоторого количества теплоты от источника тепла с более высокой температурой к источнику с более низкой температурой. Из постулата Томсона следует невозможность получения работы в тепловом двигателе, равной отнятому от горячего источника теплу Q 1, т. е. обязательно должно выполняться неравенство L<Q 1.
Но по закону сохранения энергии
L=Q 1 – Q 2,
где Q 2 – отводимое к холодному источнику тепло.
Поэтому в тепловых двигателях, какой бы конструкции они ни были, всегда должно быть Q 2 >0. Отношение работы L к теплу Q 1 называют терми ческим коэффициентом полезного действия
η t =(L /Q 1)<1.
Таким образом, термический к. п. д. теплового двигателя всегда должен быть меньше единицы. Это положение впервые было доказано С. Карно (1824 г.) путем рассмотрения возможной работы идеального (обратимого) теплового
двигателя в условиях бесконечноёмких горячего и холодного источников тепла (T 1 =const и T 2 =const). С. Карно было доказано, что максимальный термический к. п. д. идеального теплового двигателя в условиях постоянства температур T 1 и T 2 составляет величину:
η t =1–(T 2 /T 1)<1.
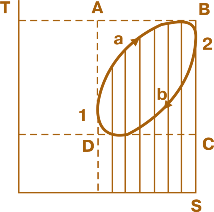 Рис. 2.1. TS – диаграмма термодинамического кругового процесса
Рис. 2.1. TS – диаграмма термодинамического кругового процесса
Анализируя выводы Карно, Клаузиус заметил, что для идеального теплового двигателя соблюдается соотношение
Q 1 /T 1 =Q 2 /T 2. Исходя из этого, Клаузиусом в конце XIX века была введена новая термодинамическая функция – энтропия, определяемая как отношение количества подведенной или отведенной теплоты к абсолютной температуре ее подвода или отвода:
Ѕ =Q/T. Эта новая величина – энтропия (от греч. εν – в и τροπη – поворот, превращение) – математически строго определена, но физически мало наглядна. Клаузиус показал, что абсолютное значение энтропии остается неопределенным, определены лишь ее изменения в термически изолированных необратимых системах; в идеальном случае обратимых процессов энтропия остается постоянной.
Введению этой новой величины физики противодействовали весьма энергично, особенно изза ее таинственного характера, обусловленного главным образом тем, что она не действует на наши органы чувств. Поскольку ее изменение равно нулю для идеальных обратимых процессов и положительно для реальных обратимых процессов, то энтропия есть мера отклонения реального процесса от идеального. Этим объясняется данное Клаузиусом название этой величины, которое этимологически означает «изменение».
Введение этой величины позволило создать температурно-энтропийные, или так называемые TS- диаграммы (рис. 2.1), с помощью которых можно оценивать термодинамические процессы и определять эффективность тепловых двигателей.
На площади такой диаграммы точки отвечают определённому состоянию газообразного рабочего тела, поскольку для каждой из них известны две величины – параметры состояния, которые характеризуют газ. В данном случае ими будут T и S (т. е. температура и энтропия).
Если к некоторому количеству газа, состояние которого определено на рисунке точкой 1, подвести определённое количество теплоты dQ, то система перейдёт путём a в состояние, характеризуемое точкой 2, а затем вследствие отвода теплоты система путем b вернётся в первоначальное состояние (точка 1). Это означает, что система осуществила круговой процесс.
Для любого элементарного участка такого процесса существует зависимость
где dS – увеличение функции состояния системы – энтропии, кДж/К; dQ – количество подведённой теплоты, кДж; T – температура, при которой подводится теплота, К.
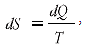
Поскольку dQ = TdS, то понятно, что количество подведенной теплоты в каком-либо процессе, в том числе в процессе, определяется на TS-диаграмме в определённом масштабе площадью, обозначаемой вертикальной штриховкой, а количество отведенного тепла – площадью с наклонной штриховкой. Площадь, ограниченная кривыми1 – 2 и 2 – 1, является разницей между указанными площадями. Она характеризует количество теплоты, преобразованной, согласно закону сохранения энергии, в работу, выполненную 1 кг газа за цикл. Термодинамический к.п.д. цикла определяется как отношение этой площади к заштрихованной вертикальными линиями, которая соответствует подведенной энергии. Итак, из сказанного следует, что к.п.д. возрастает тем больше, чем выше расположена верхняя кривая и ниже – нижняя.
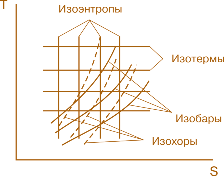 Рис. 2.2. Процессы в газах (изоэнтропы, изотермы, изохоры, изобары)
Рис. 2.2. Процессы в газах (изоэнтропы, изотермы, изохоры, изобары)
Если верхняя и нижняя температурные границы цикла жестко определены (на рис.2.1 они обозначены пунктиром), тогда к.п.д. тем выше, чем более близкой к прямоугольнику ABCD будет форма площади цикла1 – 2 и 2 – 1. Цикл, который на TS-диаграмме изображен прямоугольником ABCD, получил название цикла Карно. К.п.д. цикла Карно невозможно превысить никакими средствами, а его величина зависит только от температуры: наиболее высокой (изотермаАВ) и наиболее низкой (изотерма DC):
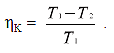
η K = В этом заключается суть второго закона термодинамики. Из уравнения видно, что основным путем увеличения эффективности тепловых двигателей является повышение верхней температуры T 1 , при которой теплота подводится к рабочему телу, и понижение нижней T 2, при которой теплота отводится.
Теплота в конечном счете отводится к окружающей среде (в воздух или в воду). В связи с этим минимально возможная температура отвода теплоты близка к температуре этих сред.
Соотношение, справедливое и для обратимых (знак равенства), и для необратимых (знак >) процессов в любой системе, представляет собой аналитическое выражение второго закона термодинамики:
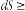
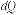
Относительно процессов, из которых составляется цикл Карно (см. рис. 2.1), не было выдвинуто условий их протекания, кроме того, что в процессе а теплота подводится, а в процессе b – отводится. На самом деле среди многочисленных возможных процессов часто выделяются четыре вида, условием осуществления которых есть постоянство одного из параметров состояния газа (рис. 2.2).
Изотермический процесс происходит при постоянной температуре; на TS -диаграмме изображается горизонтальными линиями.
Изоэнтропный процесс расширения или сжатия происходит без трения таким образом, что тепло к газу не подводится и не отводится (dQ =0). На TS -диаграмме этот процесс изображается вертикальными прямыми.
Изобарный процесс осуществляется при постоянном давлении p. Такие процессы очень широко представлены в природе и технике. На ТS диаграмме изобара изображена кривой линией.
Изохорные изменения состояния газа происходят, когда его нагревают или охлаждают при постоянном объеме. Изохора на TS- диаграмме изображена пунктирной кривой, более крутой, чем изобара.
Термодинамический цикл тепловых двигателей обычно состоит из ряда вышеназванных процессов. Для иллюстрации приведем в TS- диаграмме термодинамический цикл, по которому работает традиционная установка тепловой электрической станции, так называемый пароводяной цикл Ренкина (рис. 2.3).
Питательная вода, которая поступает в паровой котел, нагревается в нем (изобараа – в), испаряется (изотерма, которая совпадает с изобаройв – с), образовавшийся пар перегревается в пароперегревателе (изобарас – д) до температуры Т1. Далее в турбине происходит изоэнтропное расширение пара (изоэнтроп аd – е), а в конденсаторе при Т 2 =const – его конденсация (изотерма е – f, которая совпадает с изобарой). Затем конденсат подается в котел насосом (изоэнтроп аf – а).
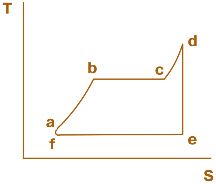 Рис. 2.3. Термодинамический цикл, по которому работает традиционная установка тепловой электрической станции (пароводяной цикл Ренкина)
Рис. 2.3. Термодинамический цикл, по которому работает традиционная установка тепловой электрической станции (пароводяной цикл Ренкина)
2.3. Первый закон термодинамики
2.5. Понятие эксергии



