Книга 5. Электроэнергетика и охрана окружающей среды. Функционирование энергетики в современном мире
3.2.1. Строение атома
Все в мире состоит из молекул, которые представляют собой сложные комплексы взаимодействующих атомов. Молекулы — это наименьшие частицы вещества, сохраняющие его химические свойства. Молекула состоит из одинаковых (в простом веществе) или разных (в химическом соединении) атомов, объединенных химическими связями.
Атом – наименьшая частица химического элемента, которая является носителем его химических свойств. Все атомы химических элементов имеют одинаковую структуру. Их линейный размер в диаметре составляет примерно 10-10м. Атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов, которые размещены на электронных орбитах атома.
Электроны в атоме сгруппированы по оболочкам (слоям), которые принято обозначать буквами К, L, М, N, O, P, Q. Строение электронных оболочек подчинено строгому физическому закону – «в одном атоме не может быть двух электронов, находящихся в одном и том же энергетическом состоянии». Это состояние определяется тремя параметрами: энергией связи электрона в атоме, характером его вращения вокруг ядра (орбитальным моментом) и вращения вокруг собственной оси (спином). Каждая электронная орбита соответствует вполне конкретному значению энергии связи, благодаря которой электроны удерживаются в атоме. Электроны, получившие дополнительную энергию, могут переходить на орбиту, более удаленную от ядра, или вообще покидать пределы атома. Состояние атома, в котором электроны перешли со свойственной им оболочки на более удаленную от ядра орбиту, является, как правило, неустойчивым. Время его нахождения в таком возбужденном состоянии не превышает 10-8с. При переходе электрона с удаленной на более близкую к ядру орбиту выделяется энергия.
Ядро – центральная часть атома, состоящая из положительно заряженных протонов и нейтральных нейтронов. Эти частицы, называемые нуклонами, удерживаются в ядрах короткодействующими силами притяжения, возникающими за счет обмена квантами так называемого «сильного» взаимодействия. Размеры ядра примерно в 10–100 тысяч раз меньше линейных размеров атома (диаметр ядра порядка 10-14м). Несмотря на относительно малые размеры ядра, в нем сосредоточена практически вся масса атома, что обусловливает очень высокую плотность ядерного вещества. Масса ядра несколько ниже суммы масс составляющих его протонов и нейтронов в свободном состоянии. Эта разница называется «дефектом массы».
Ядро элемента X принято обозначать как 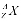 илиX7A, где Z – заряд ядра, равный числу протонов, определяющий атомный номер ядра;A– массовое число ядра, равное суммарному числу протонов и нейтронов.
илиX7A, где Z – заряд ядра, равный числу протонов, определяющий атомный номер ядра;A– массовое число ядра, равное суммарному числу протонов и нейтронов.
Протон – элементарная частица, носящая единичный положительный заряд, равный по абсолютной величине заряду электрона. Он является ядром атома простейшего водорода.
Нейтрон – незаряженная элементарная частица с массой покоя, несколько превышающей массу протона. В свободном состоянии нейтрон – неустойчивая частица и претерпевает превращения. Большая проникающая способность нейтронов объясняется тем, что эти частицы не заряжены. Они свободно пролетают сквозь атомы, не взаимодействуя с их электронами и не задерживаясь в своем движении, если только не сталкиваются с ядрами.
Протон и нейтрон обозначаются соответственно 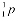 и
и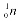 , где нижние индексы обозначают заряд, а верхние – массу в атомных единицах массы (а. е. м.), которая округляется до единицы. В качестве а. е. м. принята 1/12 часть массы атома углерода. Масса протона и нейтрона в 1840 раз больше массы электрона. Для протонов и нейтронов существует общее название нуклоны. Положительный заряд ядра определяется количеством протонов в нем. Атом любого химического элемента характеризуется двумя главными параметрами: массовым числом и атомным номером элемента в Периодической системе химических элементов Д.И. Менделеева. Массовое число А– суммарное число протонов и нейтронов в ядре данного атома. Атомный номер Z–число протонов, входящих в состав ядра. Исходя из этих определений, число нейтронов в ядре равно N=A–Z.
, где нижние индексы обозначают заряд, а верхние – массу в атомных единицах массы (а. е. м.), которая округляется до единицы. В качестве а. е. м. принята 1/12 часть массы атома углерода. Масса протона и нейтрона в 1840 раз больше массы электрона. Для протонов и нейтронов существует общее название нуклоны. Положительный заряд ядра определяется количеством протонов в нем. Атом любого химического элемента характеризуется двумя главными параметрами: массовым числом и атомным номером элемента в Периодической системе химических элементов Д.И. Менделеева. Массовое число А– суммарное число протонов и нейтронов в ядре данного атома. Атомный номер Z–число протонов, входящих в состав ядра. Исходя из этих определений, число нейтронов в ядре равно N=A–Z.
Ядра элементов с одинаковым числом протонов, но разным числом нейтронов называются изотопами. В качестве примера можно привести природный уран, который имеет три изотопа: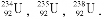 В настоящее время известно около 1500 изотопов. Одни из них устойчивые (стабильные), другие – неустойчивые, радиоактивные.
В настоящее время известно около 1500 изотопов. Одни из них устойчивые (стабильные), другие – неустойчивые, радиоактивные.
Заряд и массовое число являются основными характеристиками атомных ядер. Разновидности атомов, характеризующиеся определенным массовым числом и атомным номером, называют нуклидами и обозначают символом элемента с указанием атомного номера (внизу слева) и массового числа (вверху слева), например: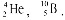 В периодической системе элементы расположены строго последовательно в порядке возрастания заряда ядер их атомов. При этом свойства элементов находятся в периодической зависимости от заряда ядер их атомов. В каждом периоде системы химических элементов Д.И. Менделеева идет построение нового электронного слоя, а в больших периодах также достройка внутренних слоев. Поэтому число электронных слоев в атоме обычно равно номеру периода, в котором находится соответствующий элемент.
В периодической системе элементы расположены строго последовательно в порядке возрастания заряда ядер их атомов. При этом свойства элементов находятся в периодической зависимости от заряда ядер их атомов. В каждом периоде системы химических элементов Д.И. Менделеева идет построение нового электронного слоя, а в больших периодах также достройка внутренних слоев. Поэтому число электронных слоев в атоме обычно равно номеру периода, в котором находится соответствующий элемент.
При нормальном состоянии атома количество его электронов, движущихся вокруг ядра, соответствует количеству протонов в ядре, что приводит к нейтрализации суммарных отрицательных зарядов электронов и положительного заряда ядра. В этом состоянии атом является электрически нейтральной системой.
Устойчивость атомных ядер обусловлена ядерными силами притяжения, удерживающими нуклоны в ядре. Особенность их заключается в том, что они достаточно велики на расстояниях, сопоставимых с размерами ядра (в 2–3 раза превосходят силы отталкивания Кулона, действующие между заряженными частицами, входящими в состав ядра). Эта особенность ядерных сил обусловлена энергией связи, которая составляет несколько миллионов электрон-вольт, что от нескольких сотен до нескольких тысяч раз превышает энергию связи электрона в атоме. При этом важно подчеркнуть, что устойчивость ядер атомов обеспечивается лишь при вполне определенных соотношениях протонов и нейтронов. Для легких ядер их число почти одинаково, для тяжелых – доля нейтронов возрастает. Ядра атомов, которые находятся в конце таблицы Менделеева (с атомным номером Z>82), как правило, неустойчивы. При увеличении суммарного числа нуклонов уменьшается сила ядерных притяжений и эффект кулоновских сил отталкивания начинает превалировать. В таких атомах силы ядерных притяжений уже не хватает для обеспечения полной устойчивости ядер, что приводит к процессам их внутренней перестройки (самопроизвольным превращениям), сопровождающимся выделением энергии. Таким образом, у химических элементов с атомным номером (зарядом ядра) Z<83 существуют как стабильные, так и радиоактивные изотопы. У элементов с атомным номером Z>84 имеются лишь радиоактивные изотопы. Такие изотопы называют радионуклидами.
Процесс спонтанного перехода атомного ядра в другое ядро или ядра с испусканием при этом различных частиц называется радиоактивным распадом, или радиоактивностью.
3.1. Общие сведения об атомной энергетике, радиоактивности и воздействии АЭС на окружающую среду
3.2.2. Общая характеристика радиоактивности



